Сравнительное исследование каталитической активности Pt/C и PtхNi/C материалов в реакции электровосстановления кислорода
Аннотация
Дата поступления статьи: 28.10.2013Изучена каталитическая активность Pt/C и PtхNi/C электрокатализаторов, полученных методом жидкофазного боргидридного синтеза. Установлено, что удельная активность Pt3,7Ni/C катализатора в состоянии «как получено» в реакции электровосстановления кислорода выше, по сравнению с Pt/C материалом.
Ключевые слова: платиносодержащие электрокатализаторы, коррозионная стабильность, наночастицы, топливные элементы, рентгеновская дифрактометрия, боргидридный синтез
05.17.01 - Технология неорганических веществ
05.17.03 - Технология электрохимических процессов и защита от коррозии
Введение
Увеличение активности и стабильности нанесенных платиносодержащих катализаторов чрезвычайно важно с точки зрения создания конкурентоспособных низкотемпературных топливных элементов [1-3]. Для реализации этой цели предлагается целый ряд подходов, в числе которых применение новых типов каталитических носителей [4-6], оптимизация среднего размера [7-10] и формы [11-14] металлических наночастиц, использование би- и триметаллических наночастиц [10], в том числе и наночастиц с особой архитектурой [15-19].
Многие исследователи отмечают, что использование двухкомпонентных наночастиц на углеродном носителе, например PtCo [20-23], PtNi [24-26], PtFe [27], PtCu [28], PtCr [20, 29], позволяет увеличить каталитическую активность при по сравнению с нанесенными наночастицами чистой платины. Так, например, Стаменкович [26] показал значительное увеличение (до 10 раз) каталичической активности граней твердого раствора PtNi (111) по сравнению с аналогичными гранями платины.
Целью настоящей работы являлось сравнительное исследование кинетики электровосстановления кислорода на Pt/C и PtNi/C электрокатализаторах в состояниях «как получено» и после обработки в агрессивной среде. Все исследованные материалы были получены методом химического восстановления прекурсоров металлов в жидкой фазе (см. раздел «Методика эксперимента»), позволяющим существенно влиять на микроструктурные характеристики платиносодержащих катализаторов [30-34].
Методика эксперимента
Pt/C и PtxNi/C электрокатализаторы были получены восстановлением прекурсоров металлов (платинохлороводородной кислоты (H2PtCl6*6H2O) и нитрата никеля Ni(NO3)2*6H2O) из углеродной суспензии на основе водно-глицеринового растворителя (методика синтеза подробно описана в [30]). В качестве углеродного носителя использовали сажу Vulcan XC-72 с удельной площадью поверхности 250-280 м2/г. Углеродную суспензию готовили таким образом, чтобы при полном восстановлении прекурсоров металлов получить катализаторы с 30% содержанием Pt по массе и, в случае сплава, - состав с молярным соотношением Pt:Ni – 3:1. Для оценки коррозионной устойчивости полученные материалы обрабатывали в 1 M H2SO4 в течение 1 часа при температуре 100 ˚С. Затем анализировали изменение микроструктуры, состава и массовой доли металлов.
Рентгеновские дифрактограммы Pt/C и PtМ/C материалов получали на дифрактометре Rigaku Ultima IV (CuKα (λ = 0,154056 нм), Кβ фильтр – Ni, напряжение 40 кВ, ток 40 мА). Размеры кристаллитов (Dhkl – область когерентного рассеяния) находили методом Вильямсона – Холла [35] из уравнения (1).
βs cosθ/λ = (2εhkl)sinθ/λ + K/Dhkl (1)
где θ – брегговский угол отражения, К – константа Шерера, βs – физическое уширение, связанное с инструментальной функцией разрешения дифрактометра, ε – величина микродеформации, λ – длина волны рентгеновского излучения. Химический состав полученных материалов определяли методом рентгенофлуоресцентной спектроскопии на рентгеновском спектрометре ARL OPTIM’X.
Для определения площади электрохимически активной поверхности катализаторов (Sак) использовали метод циклической вольтамперометрии на стационарном электроде [31]. Исследование кинетики электровосстановления кислорода было проведено на вращающемся дисковом электроде (площадь электрода - 0,196 см2) в комплекте с бипотенциостатом Pine AFCBP1 (Pain Research Instrumentation, USA). Измерения проводили в стандартной трехэлектродной ячейке, термостатируемой при 23°С, электролит - 1М H2SO4, насыщенная кислородом. Для стандартизации поверхности катализатора регистрировали циклические вольтамперограммы (25 циклов), со скоростью развертки потенциала 100 мВ/с, в диапазоне потенциалов от 1,192 до 0,022 В (СВЭ). После стандартизации электрода снимали серию вольтамперограмм с линейной разверткой потенциала (скорость развертки потенциала 20 мВ/с) от 1,192 до 0,022 В (СВЭ) при скоростях вращения дискового электрода: 400, 600, 1000, 1400, 1800, 2400 об/мин. Для сравнения характеристик различных катализаторов измеренные токи нормировали на массу платины (A/г(Pt)) и на активную площадь поверхности катализатора (мА/см2 (Pt)). Для формирования на рабочем электроде тонкого каталитического слоя 20 мкл специально приготовленных «каталитических чернил» наносили на стеклографитовую поверхность электрода и сушили при 80˚ С в течение 40 минут. Каталитические чернила представляли собой водно-органическую суспензию катализатора, которую готовили, добавляя 0,004 г катализатора в смесь 1,6 мл бидистиллированной воды, 0,4 мл изопропанола и 4 мкл 5% раствора Nafion [31].
Результаты и обсуждение
Данные о составе и микроструктурных характеристиках полученных Pt/C и PtxNi/C (Vulcan XC72) материалов приведены в таблице 1.
Химический состав материала PN несколько отличается от ожидаемого (Pt3Ni), что может быть связанно с неполным восстановлением ионов никеля (2+). После обработки PN в 1М H2SO4 часть никеля с поверхности наночастиц растворяется, что приводит к её обогащению платиной [34, 36-37]. Незначительные изменения среднего размера кристаллитов и площади электрохимически активной поверхности катализатора (Sак) после коррозионной обработки (таб. 1) свидетельствуют о стабильности данного катализатора.
Таблица 1.
Некоторые характеристики синтезированных PtxNi/C и Pt/C (Vulcan XC72) материалов
Образец |
Состав по данным РФлА |
Параметр кристаллической решетки, нм |
Средний размер ОКР |
Sак (СО), |
2θ (220), град |
|
PN |
Pt3,7Ni |
0,3907 |
2,0 |
22 |
67,92 |
|
PNcor |
Pt5,6Ni |
0,3905 |
2,3 |
19 |
67,94 |
|
PT |
Pt/C |
0,3919 |
2,8 |
25 |
67,61 |
Для Pt3,7Ni/C материала PN максимум отражения (220) на рентгеновских дифрактограммах смещен относительно максимума для чистой платины в область больших углов 2θ (рис. 1), что связанно с образованием твердого раствора замещения никеля в платине с пространственной группой Fm-3m (10870647 по базе ICDD). После обработки материала PN в кислоте наблюдается лишь незначительное смещение максимума отражения (220) в сторону меньших значений 2θ. По-видимому, происходит преимущественное растворение никеля, не вошедшего в состав твердого раствора с платиной и находившегося в материале PN в виде рентгеноаморфных оксидов [31, 36].
Все три исследованных катализатора характеризуются близкими значениями Sак (Таб. 1). Тот факт, что обработка катализатора PN в горячей 1М H2SO4 приводит лишь к незначительному уменьшению величины Sак, подтверждает ранее сделанный вывод о его стабильности.
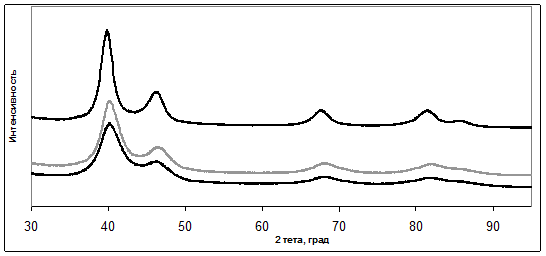
Риc. 1. - Рентгенограммы Pt/C (1) и PtxNi/C материалов в состоянии «как получено - Pt3,7Ni/C (2) и после обработки в 1M H2SO4 - Pt5,6Ni C (3).
По результатам вольтамперных измерений на вращающемся дисковом электроде 1 М H2SO4 (рис. 2) были определены кинетические параметры реакции электровосстановления кислорода (РВК) (таб. 2). Расчет проводился с использованием уравнения Коутецкого – Левича [20, 38]:
1/i = 1/iк + 1/iд = 1/iк + 1/Zω0,5(2)
Z = 0,62 nFD2/3υ-1/6c (3)
где i – ток на дисковом электроде, А/см2; iк – кинетический ток, А/см2; iд – диффузионный ток, А/см2; ω – скорость вращения дискового электрода (рад/с); n – количество электронов, участвующих в электрохимической реакции; F – постоянная Фарадея, 96,485 Кл/моль; D – коэффициент диффузии, 1,8*10-5 см2/с [20]; υ – кинематическая вязкость электролита, 0,010 см2/с [20]; с – концентрация кислорода в растворе, 1,13*10-6 моль/см3 [20].
Наибольшую активность в реакции электровосстановления кислорода, как в расчете на массу металлической компоненты, так и в расчете на активную площадь поверхности металлов, продемонстрировал Pt3,7Ni/C материал PN (таб. 2). После обработки в кислоте в течение 1 часа катализатор (PNcor) снижает свою масс-активность, что обусловлено уменьшением общей площади активной поверхности и снижением концентрации никеля на поверхности металлических наночастиц (состав материала меняется до Pt5,6Ni/C). При этом удельная активность (катодный ток в расчете на электрохимически активную площадь поверхности) уменьшается не более, чем на 10 % (таб. 2). Отметим, что наблюдаемое (таб. 2) отсутствие корреляции между средним размером кристаллитов и Sак катализаторов скорее всего обусловлено усиливающейся в ряду PT < PN < PNcor агломерацией наночастиц.
Для Pt/C материала реализуется характерный 4-х электронный механизм реакции, что хорошо согласуется с литературными данными [20,38]. Для PtxNi/C катализатора в состоянии «как получено» (PN) рассчитанное число электронов, участвующих в электрохимической реакции меньше, а для PNcor – существенно меньше 4-х, что может быть обусловлено вкладом параллельной 2-х электронной реакции электровосстановления кислорода с образованием пероксида водорода [38-39]. По-видимому, такой эффект связан не с влиянием атомов легирующего компонента как таковым, а обусловлен разупорядочением (аморфизацией) поверхностного слоя наночастиц, усиливающейся при легировании платины никелем (в условиях низкотемпературного синтеза) и, особенно, при селективном растворении никеля с поверхности наночастиц.
Таблица 2
Сводные результаты электрохимических измерений на ВДЭ. Dср – средний размер кристаллитов, нм. Значения токов (j-масс – удельный ток в расчете на массу металлов (А/гPt), jудел – удельный ток в расчете на единицу площади поверхности металлов (А/м2Pt)) вычислены при потенциале 0,7В и скорости вращения электрода 1000 об/мин.
Образец |
Состав |
Sак (СО), м2/гPt |
Dср, нм |
jмасс |
jудел |
Число электронов, n |
|
PN |
Pt3,7Ni |
22 |
2,0 |
44,68 |
2,012 |
3,45 |
|
PNcor |
Pt5,6Ni |
19 |
2,3 |
33,73 |
1,813 |
2,90 |
|
PT |
Pt |
25 |
2,8 |
37,54 |
1,501 |
4,00 |
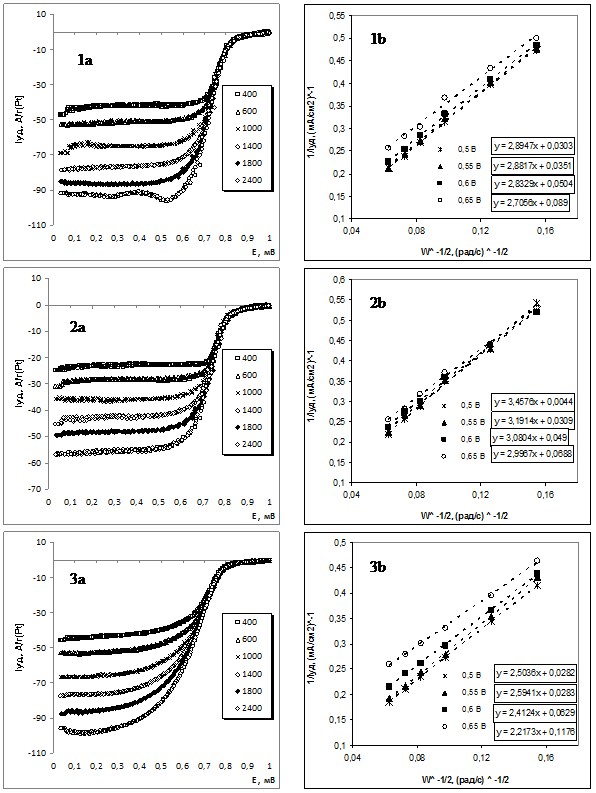
Рис. 2. - Вольтамперограммы с линейной разверткой потенциала (а) измеренные при различных скоростях вращения дискового электрода и зависимости Коутецкого-Левича (b) при различных потенциалах для: Pt3,7Ni/C катализатора PN (1); Pt5,6Ni катализатора PNcor, полученного после обработки образца PN в 1M H2SO4 (2); Pt/C катализатора PT (3)
Выводы
По результатам сравнительного исследования Pt/C и PtхNi/C электрокатализаторов, полученных методом жидкофазного восстановления H2PtCl6 и Ni(NO3)2 в водно-глицериновых растворах, установлено, что для удельная активность (А/см2) Pt3,7Ni/C катализатора в состоянии «как получено» в реакции электровосстановления кислорода выше, нежели у Pt/C материала. После обработки Pt3,7Ni/C материала в горячей кислоте происходит частичное растворение никеля из поверхностных слоев наночастиц, а интегральный состав металлической компоненты изменяется до Pt5,6Ni. При этом площадь электрохимически активной поверхности катализатора и его удельная активность незначительно снижаются.
Реакция электровосстановления кислорода на синтезированных Pt/C и Pt-Ni/C катализаторах PT, PN и PNcor преимущественно протекает по 4х электронному механизму, хотя для Pt3,7Ni/C и, особенно, для Pt5,6Ni/C, по-видимому, существенный вклад вносит 2-х электронная реакция, приводящая к образованию пероксида водорода. Увеличение вклада побочных реакций электровосстановления кислорода на никельсодержащих катализаторах не связано с наличием (или концентрацией) никеля в металлической фазе, поскольку наиболее выражено на обедненном никелем Pt5,6Ni/C электроде. По-видимому, причиной такого эффекта может являться разупорядочение поверхности усиливающееся в ряду PT < PN < PNcor.
Наиболее высокую массовую и удельную активность в РВК проявил Pt3,7Ni/C (PN) электрокатализатор (состояние «как получено»). После обработки в кислоте содержание никеля в катализаторе уменьшается (до состава Pt5,6Ni/C), а его удельные характеристики снижаются. Тем не менее, значение удельной каталитической активности остается более высоким, нежели у синтезированного в аналогичных условиях Pt/C катализатора.
Авторы выражают благодарность Центру коллективного пользования "Диагностика структуры и свойств наноматериалов" НИУ "БелГУ", г. Белгород.
Работа выполнена при поддержке Минобрнауки РФ (госконтракт № 14.132.21.1468).
Литература:
1. Thompsett D. // Catalysts for the Proton Exchange Membrane Fuel Cell, in: Handbook of Fuel Cells. Fundamentals, Technology and Applications. Editors: Vielstich W., Lamm A., Gasteiger H.A. N.Y. Sohn, Wiley & Sons Ltd., 2003. V. 3. P. 6-1 – 6-23 (Chapter 6).
2. Ярославцев А.Б., Добровольский Ю.А., Шаглаева Н.С., Фролова Л.А., Герасимова Е.В., Сангинов Е.А. Наноструктурированные материалы для низкотемпературных топливных элементов // Успехи химии. – 2012. - Том 81. – С. - 191-220.
3. Bagotsky V.S. Fuel cells: problems and solutions Wiley & Sons Ltd 2012. – 385.
4. Surbhi Sharma, Bruno G. Pollet Support materials for PEMFC and DMFC electrocatalysts // Journal of Power Sources. - 2012. - V. 208. – p. 96–119.
5. Shibin Yin, Shichun Mu, Haifeng Lv, Niancai Cheng, Mu Pan, Zhengyi Fuм A highly stable catalyst for PEM fuel cell based on durable titanium diboride support and polymer stabilization // Applied Catalysis B: Environmental. – 2010. – V.93. – p. 233–240.
6. Soon Hyung Kang, Yung-Eun Sung, and William H. Smyr The Effectiveness of Sputtered PtCo Catalysts on TiO2 Nanotube Arrays for the Oxygen Reduction Reaction // Journal of The Electrochemical Society. - 2008. – V. 155. – p. 1128 - 1135.
7. Kinoshita K. Particle Size Effects for Oxygen Reduction on Highly Dispersed Platinum in Acid Electrolytes // J. Electrochem. Soc. – 1990. - V. 137. – p. 845 – 848.
8. Billy E., Maillard F., Morin A., Guetaz L., Emieux F., Thurier C., Doppelt P., Donet S., Mailley S. Impact of ultra-low Pt loadings on the performance of anode/cathode in a proton-exchange membrane fuel cell // Journal of Power Sources. - 2010. – V.195. – p. 2737–2746.
9. Bing Joe Hwang, Sakkarapalayam Murugesan Senthil Kumar, Ching-Hsiang Chen, Ren-Wen Chang, Din-Goa Liu, and Jyh-Fu Lee Size and Alloying Extent Dependent Physiochemical Properties of Pt Ag/C Nanoparticles Synthesized by the Ethylene Glycol Method // J. Phys. Chem. C. – 2008. – V. 112. – p. 2370 – 2377.
10. Myoung-ki Min, Jihoon Cho, Kyuwoong Cho, Hasuck Kim Particle size and alloying effects of Pt-based alloy catalysts for fuel cell applications // Electrochimica Acta. - 2000. - V. 45 - p. 4211–4217.
11. Matsuzawa K., Fukushima T., Yamada H., and Inaba M. Preparation of Cubic Platinum Nanoparticles of Different Sizes and Their Electrochemical Properties // ECS Transactions. – 2007. – V. 11. – p. 181-189.
12. Leontyev I.N., Belenov S.V., Guterman V.E., Haghi-Ashtiani P., Shaganov A., Dkhil B. Catalytic Activity of Carbon Supported Pt/C Nano-Electrocatalysts. Why Reducing the Size of Pt Nanoparticles is not Always Beneficient // The Journal of Physical Chemistry. – 2011. - V. 115. - p. 5429–5434.
13. Липкин М.С., Смирнова Н.В., Куриганова А.Б. Изучение возможности катодной интеркаляции щелочных металлов в платину под действием переменного импульсного тока [Электронный ресурс] // «Инженерный вестник Дона», 2012, №1. – Режим доступа: http://ivdon.ru/magazine/archive/n1y2012/627 (доступ свободный) – Загл. с экрана. – Яз. рус.
14. Смирнова Н.В., Куриганова А.Б. Электрохимическое разрушение платины – новый путь синтеза наноразмерных Pt/C катализаторов для низкотемпературных топливных элементов [Электронный ресурс] // «Инженерный вестник Дона», 2011, №1. – Режим доступа: http://ivdon.ru/magazine/archive/n1y2011/360 (доступ свободный) – Загл. с экрана. – Яз. рус.
15. Riccardo Ferrando, Julius Jellinek, and Roy L. Johnston Nanoalloys: From Theory to Applications of Alloy Clusters and Nanoparticles // Chemical Reviews. – 2008. - V. 108. – p. 845-910.
16. Quang Thang Trinh, Jinhua Yang, Jim Yang Lee, Mark Saeys Computational and experimental study of the Volcano behavior of the oxygen reduction activity of PdM@PdPt/C (M = Pt, Ni, Co, Fe, and Cr) core–shell electrocatalysts // Journal of Catalysis. – 2012. – V. 291. – p. 26–35.
17. Dubau L., Durst J., Maillard F., Guétaz L., Chatenet M., André J., Rossinot E. Further insights into the durability of Pt3Co/C electrocatalysts: Formation of “hollow” Pt nanoparticles induced by the Kirkendall effect // Electrochimica Acta. - 2011. – V.56. – p. 10658–10667.
18. Mee Rahn Kim, Dong Ki Lee, Du-Jeon Jang Facile fabrication of hollow Pt/Ag nanocomposites having enhanced catalytic properties // Applied Catalysis B: Environmental. - 2011. – V.103. –p. 253–260.
19. Yin Y., Rioux R.M., Erdonmez C.K., Hughes S., Somorjal G.A., Alivisatos A.P. Formation of Hollow Nanocrystals Through the Nanoscale Kirkendall Effect // Science. – 2004. - V. 304. - p. 711-714.
20. Min Ku Jeon, Yuan Zhang, Paul J. McGinn A comparative study of PtCo, PtCr, and PtCoCr catalysts for oxygen electro-reduction reaction // Electrochimica Acta. – 2010. – V.55. – p. 5318–5325.
21. Salgado J. R. C., Antolini E., Gonzalez E. R. Pt-Co/C Electrocatalysts for Oxygen Reduction in H2/O2 PEMFCs Synthesized by Borohydride Method // Journal of The Electrochemical Society. - 2004. - V.151. - p. A2143 - A2149
22. Lima F.H.B., Lizcano-Valbuena W.H., Teixeira-Neto E., Nart F.C., Gonzalez E.R., Ticianelli E.A. Pt-Co/C nanoparticles as electrocatalysts for oxygen reduction in H2SO4 and H2SO4/CH3OH electrolytes // Electrochimica Acta. - 2006. - V. 52. - p. 385-393.
23. Antolini E., Salgado J.R.C., Giz M.J., Gonzalez E. Effects of geometric and electronic factors on ORR activity of Carbon supported Pt–Co electrocatalysts in PEM fuel cells // International Journal of Hydrogen Energy. - 2005. - V. 30. - p. 1213–1220.
24. Drillet J.-F., Ee A., Friedemann J., Ko¨tz R., B. Schnyder, Schmidt V.M. Oxygen reduction at Pt and Pt70Ni30 in H2SO4/CH3OH solution // Electrochimica Acta. - 2002. – V. 47. – p. 1983 - 1988.
25. Hui Yang, Walter Vogel, Claude Lamy, and Nicola´s Alonso-Vante Structure and Electrocatalytic Activity of Carbon-Supported Pt-Ni Alloy Nanoparticles Toward the Oxygen Reduction Reaction // J. Phys. Chem. B. - 2004. – V. 108. – p. 11024-11034.
26. Vojislav R. Stamenkovic, Ben Fowler, Bongjin Simon Mun, Guofeng Wang, Philip N. Ross, Christopher A. Lucas, Nenad M. Markovic, Improved Oxygen Reduction Activity on Pt3Ni(111) via Increased Surface Site Availability // Science. – 2007. - V. 315. – p. 493.
27. Shukla A.K., Raman R.K., Choudhury N.A., Priolkar K.R., Sarode P.R., Emura S., Kumashiro R. Carbon-supported Pt–Fe alloy as a methanol-resistant oxygen-reduction catalyst for direct methanol fuel cells // Journal of Electroanalytical Chemistry. - 2004. – V.563. – p. 181–190.
28. Gaurav Gupta, Daniel A. Slanac, Pavan Kumar, Jaclyn D. Wiggins-Camacho, Xiqing Wang, Steven Swinnea, Karren L. More, Sheng Dai, Keith J. Stevenson, and Keith P. Johnston Highly Stable and Active Pt-Cu Oxygen Reduction Electrocatalysts Based on Mesoporous Graphitic Carbon Supports // Chem. Mater. – 2009. – V. 21. – p. 4515–4526.
29. Hui Yang, Nicola's Alonso-Vante, Jean-Michel Le'ger, and Claude Lamy Tailoring, Structure, and Activity of Carbon-Supported Nanosized Pt Cr Alloy Electrocatalysts for Oxygen Reduction in Pure and Methanol-Containing Electrolytes // J. Phys. Chem. B. - 2004. – V. 108. – p. 1938 – 1947.
30. Гутерман В.Е., Беленов С.В., Дымникова О.В., Ластовина Т.А., Константинова Я.Б., Пруцакова Н.В. Боргидридный синтез Pt/C и PtxNi/C электрокатализаторов: влияние состава водно - органического растворителя на состав и структуру материалов // Неорганические материалы. - 2009. – т. 45. - с. 552 - 559.
31. Гутерман В.Е., Беленов С.В., Ластовина Т.А., Фокина Е.П., Пруцакова Н.В., Константинова Я.Б. Микроструктура и электрохимически активная площадь поверхности PtM/C электрокатализаторов // Электрохимия. - 2011. - т. 47. - с. 997–1004.
32. Гутерман В.Е., Пустовая Л.Е., Гутерман А.В., Высочина Л.Л. Боргидридный синтез PtxNi-электрокатализаторов и исследование их активности в реакции электровосстановления кислорода // Электрохимия. - 2007. - Т. 43. - с. 1147-1152.
33. Беленов С.В., Гутерман В.Е. Состав, структура и коррозионная стабильность PtxNi/C электрокатализаторов с различной микроструктурой // Международный научный журнал «Альтернативная энергетика и экология». - 2011. - № 9. - с. 105 – 110.
34. Беленов С.В., Суджанская И.В. Состав, микроструктура и коррозионная стабильность PtxNi/C материалов, полученных из различных водно-органических систем // Научное обозрение. - 2012. - с. 210-217.
35. Williamson G. K. and Hall W. H. // Acta Metall. – 1953. – V. 1. – p. 22-31
36. Богдановская В.А., Тарасеич М.Р., Жутаева Г.В., Кузнецова Л.Н., Радина М.В., Резникова Л.А. Электрокаталитическая активность и коррозионная стабильность разработанных триметаллических PtM1M2 (M = Co, Cr) катодных катализаторов // Международный научный журнал «Альтернативная энергетика и экология». – 2008. – т. 10. – с. 164-175.
37. Travitsky N., Ripenbein T., Golodnitsky D., Rosenberg Y., Burshtein L., Peled E. Pt-, PtNi-and PtCo-supported catalysts for oxygen reduction in PEM fuel cells // Journal of Power Sources. – 2006. – V. 161. – p. 782–789.
38. Paulus U.A. Wokaun A., Scherer G.G., Schmidt T.J., Stamenkovic V., Markovic N.M., Ross P.N. Oxygen reduction on high surface area Pt-based alloy catalysts in comparison to well defined smooth bulk alloy electrodes // Electrochimica Acta. – 2002. – V. 47. – p. 3787–3798.
39. Qinggang He, Sanjeev Mukerjee Electrocatalysis of oxygen reduction on carbon-supported PtCo catalysts prepared by water-in-oil micro-emulsion // Electrochimica Acta. - 2010. – V.55. – p. 1709–1719.