Техника микроинъекций в аксоны нервных клеток, окруженные плотной глиальной оболочкой, с использованием ультразвуковых колебаний микрокапилляра
Аннотация
Дата поступления статьи: 18.12.2013Внутриклеточные микроинъекции – способ прямого введения клеточных органелл и растворов веществ в живые клетки. Описывается техника микроинъекций в нервные клетки путем прокола их проводящих отростков - аксонов, которые часто окруженны плотной глиальной оболочкой. Для прокола оболочки сконструирован специальный инъектор передающий микроколебания ультразвуковой частоты на инъекционный капилляр. Приводится результат использования предложенной техники микроинъекций для введения флуоресцентного маркера в крупные аксоны модельного объекта - брюшной нервной цепи речного рака, с целью визуализации морфологии аксонов.
Ключевые слова: внутриклеточная микроинъекция, нейрон, аксон, глиальная оболочка, ультразвуковые колебания, пъезоэлектрический преобразователь
05.11.17 - Приборы, системы и изделия медицинского назначения
Методика внутриклеточных микроинъекций (ВМ) – способ прямого введения клеточных органелл и растворов веществ в живые клетки [1]. В последнее время он широко применяется в биологии для генетической трансформации клеток [2], и в медицине при искусственном оплодотворении путем введения сперматозоида в цитоплазму яйцеклетки (ICSI) [3]. Традиционно метод ВМ используется для инъекций в клетки, извлеченные из биологических тканей - культивируемые на подложках, или удерживаемые специальными холдерами [4]. Особую значимость метод внутриклеточных микроинъекций, в силу своей избирательности, представляет для нейротрэкинга – визуализации путей, которые образуют в нервной системе проводящие отростки нервных клеток (методика помогает понять структурную и функциональную связность различных отделов нервной системы). Однако использование микроинъекций для введения маркера в отдельные нервные клетки в составе нервной ткани имеет ограниченное применение – маркер удается вводить лишь в те нейроны, которые не окружены многослойной окутывающей оболочкой из глиальных клеток [5]. Прокол последней с использованием традиционной техники осложнен тем, что повышение усилия, необходимого для прокола плотной глиальной оболочки, приводит к повышению вероятности поломки кончика стеклянного микрокапилляра, используемого для прокола клеток (диаметр кончика капилляра обычно составляет единицы микрон). Высокая эластичность нервной ткани приводит к ее значительной деформации до момента прокола, что создает дополнительную проблему, связанную с высоким риском сквозного прокола нервных клеток при достижении усилия достаточного для прокола окружающих оболочек.
В настоящей работе описывается техника микроинъекций в аксоны нервных клеток, окруженные многослойной глиальной оболочкой. Для отработки методики использовался модельный объект – брюшная нервная цепь (БНЦ) речного рака, которая состоит из скоплений тел нервных клеток (ганглиев), соединенных коннективами (Рис.1). Последние состоят из проводящих отростков нервных клетк – аксонов, окруженных глиальными клетками. Вдоль каждой коннективы проходят две пары гигантских аксонов (средний диаметр 50 мкм), которые залегают на относительно небольшой глубине – порядка их диаметра, но окружены многослойной глиальной оболочкой [6, 7]. Брюшную нервную цепь речного рака располагали в кювете с физиологическим раствором ван Харревельда [8], и по краям препарата фиксировали прижимами к дну кюветы (Рис.1).

Рис. 1. – Брюшная нервная цепь речного рака в экспериментальной кювете с прижимами препарата ко дну

Рис. 2. – Общий вид экспериментальной установки
За основу устройства для микроинъекций была взята конструкция Чемберса-Копака с ручной механической подачей микрокапилляра, используемая для микроинъекций изолированных клеток [9]. Китайскими авторами было показано снижение деформации ооцитов при их проколе с помощью микрокапилляра на который передавлись ультразвуковые колебания [10]. Поэтому конструкция Чемберса-Копака была совмещена с пьезоэлектрическим преобразователем стержневого типа, который имел канал для подачи давления от гидравлической системы и передавал микроколебания ультразвуковой частоты (25 кГц) на инъекционный капилляр (Рис.2). Капилляры изготавливались из борсиликатного стекла с помощью прибора для вытяжки микропипеток МЭ-3 (ИБП РАН, Пущино). Диаметр кончика составлял 5-10 микрон. В некоторых случаях кончик микрокапилляра скашивали путем заточки на алмазной шлифовальной пленке. Для снижения вероятности повреждения капилляра о дно ванночки он подавался не перпендикулярно плоскости препарата, а под углом примерно 45 градусов к его продольной оси. При проколе растяжение препарата в горизонтальной плоскости ограничивалось прижимами к дну ванночки, поэтому горизонтальная составляющая движения капилляра создавала благоприятные условия для достижения достаточного натяжения ткани для прокола глиальной оболочки. Кроме того, подача микрокапилляра под углом к плоскости препарата снижала риск сквозного прокола аксонов (Рис.3). Прокол аксонов осуществляли под микроскопом в проходящем свете при увеличении 100х, когда отчетливо видны границы гигантских аксонов.
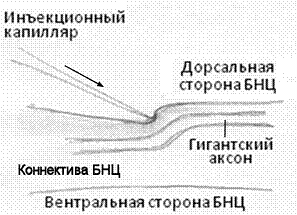
Рис. 3. – Схема подвода инъекционного капилляра к коннективе БНЦ
(вид сбоку)

Рис. 4. – Коннектива БНЦ после инъекции в медиальный гигантский аксон флуоресцентного маркера Qdot 655 (красный цвет). Синий цвет - ядра глиальных клеток, окрашенные Hoechst33342. Флуоресцентная микроскопия. Фото с дорсальной стороны препарата.
Ультразвуковые микроколебания инъекционного капилляра облегчали прокол клеточных мембран, в частности, многослойных глиальных оболочек нервных клеток. Эти же колебания способствовали эффективному введению веществ без приложения дополнительного трудноконтролируемого давления к раствору внутри капилляра. Гидравлическая система, которая представляла собой шприц с пластиковой трубочкой, заполненные вазелиновым маслом, использовалась только для поддержания раствора внутри капилляра под минимальным положительным давлением с целью предотвращения засорения капилляра. На Рис. 4 представлен результат использования предложенной техники микроинъекций для визуализации морфологии аксонов при введении раствора флуоресцентного маркера Qdot 655 (Invitrogen, США) в один из гигантских аксонов БНЦ.
Предложенная техника микроинъекций индивидуальных клеток в составе тканей с использованием ультразвуковых колебаний капилляра может быть полезной не только в исследованиях на изолированных тканях, но и в экспериментах invivo – там, где необходимо инъецировать подповерхностно расположенные клетки, окруженные плотными оболочками. Помимо визуализации клеточной морфологии предложенная техника может быть использована и для генетической трансформации клеток в составе тканей.
Конкретные физические механизмы, облегчающие прокол и введение растворов веществ в рамках предложенной нами техники, могут иметь общую природу с нелинейными эффектами действия акустических волн на биоткани [11]. Более детальное изучение этих процессов возможно с помощью методов моделирования ультразвуковых устройств, например, таких как описаны в [12].
Литература:
1. Yan Zhang and Long-Chuan Yu Single-cell microinjection technology in cell biology [Текст] // BioEssays, 2008. -№ 30.- P.606–610.
2. Kim T.K., Eberwine J.H. Mammalian cell transfection: the present and the future. [Текст] // Anal Bioanal Chem, 2010. -№ 397(8)- P.3173-31178.
3. Mansour R. Intracytoplasmic sperm injection: a state of the art technique. [Текст] // Hum Reprod Update, 1998. - № 4(1).- P.43-56.
4. Никитин В.А. Методы введения веществ и органелл в клетку в технологиях клеточной инженерии [Текст] // Цитология, 2007. -№ 49(8).- С.631-641.
5. Eilers J., Konnerth A. Dye Loading with Patch Pipettes [Электронный ресурс] // Cold Spring Harb Protoc 2009. - Режим доступа: 10.1101/pdb.prot5201 (доступ свободный) – Загл. с экрана. – Яз. англ.
6. Shrager P., Starkus J.C., Lo M.V., Peracchia C. The periaxonal space of crayfish giant axons [Текст] // J Gen Physiol, 1983. -№ 82(2).- P.221-44.
7. Beshay J.E., Hahn P., Beshay V.E., Hargittai P.T., Lieberman E.M. Activity-dependent change in morphology of the glial tubular lattice of the crayfish medial giant nerve fiber [Текст] // Glia, 2005. -№ 51(2).- P.121-31.
8. Chambers, R., Kopac, M. Microrgical technique for the study of cellular phenomena” [Текст] // McClung's Handbook of Microscopical Technique. - Hoeber, New York, 1950.- P.492–543.
9. Van Harreveld A. A Physiological Solution for Freshwater Crustaceans [Текст] // Exp Biol Med, 1936. № 34(4).- P.428-432
10. Huang, H. B., Su, H., Chen, H. Y., and Mills J. K. Piezoelectric Driven Non-toxic Injector for Automated Cell Manipulation, [Текст] // Studies in Health Technology and Informatics 163: Medicine Meets Virtual Reality, IOS Press, 2011. – №18.– P.231-235.
11. Заграй Н.П. Об особенности нелинейного акустического механизма в медицине [Электронный ресурс] // «Инженерный вестник Дона», 2012, №4 (ч.1). – Режим доступа: http://www.ivdon.ru/magazine/archive/n4p1y2012/1109 (доступ свободный) – Загл. с экрана. – Яз. рус.
12. Рябоконь А.С. Моделирование при разработке ультразвукового мобильного монитора скорости кровотока [Электронный ресурс] // «Инженерный вестник Дона», 2012, №3. – Режим доступа: http://www.ivdon.ru/magazine/archive/n3y2012/907 (доступ свободный) – Загл. с экрана. – Яз. рус.