Особенности получения покрытия диоксида марганца методом термолиза на танталовом аноде конденсатора
Аннотация
Дата поступления статьи: 20.02.2014В работе исследованы особенности получения катодного покрытия диоксида марганца на пористом танталовом аноде конденсатора. Для этого проведен сравнительный анализ термограмм нагрева кристаллогидратов нитрата марганца с анализом отходящих газов. Предложен механизм термолиза нитрата марганца и причина возникновения дефектов на поверхности покрытия диоксида марганца, нарушающих целостность катода танталового конденсатора.
Ключевые слова: диоксид марганца, покрытие, нитрат марганца, термолиз, кристаллические дефекты, микротрубки
Диоксид марганца находит широкое применение в качестве катодного материала при производстве оксидно-полупроводниковых конденсаторов, селективных датчиков, катализаторов и химических источников тока [1-7]. При формировании покрытия MnO2 на конденсаторах установлено сопутствующее этому процессу образование кристаллов неизвестного состава, разрушающих оксидный слой MnO2 [1]. Анализ образцов конденсаторов, полученных по промышленным технологиям [5-6], показал, что катодное покрытие MnO2 имеет дефектные структуры (трещины, кристаллические образования, неоднородность морфологии). Такие дефекты способны привести к увеличению токов утечки и пробою диэлектрика конденсатора, а так же к снижению емкости и срока службы конденсаторов и химических источников тока. Состав образуемых кристаллов, причины их возникновения на поверхности диоксида марганца ранее не были исследованы. В связи с этим, целью исследования являлось выявление причин образования кристаллов на поверхности и их состава на покрытии MnO2 на пористых танталовых анодах конденсаторов.
Экспериментальная часть
Аноды с нанесенным покрытием диоксида марганца, полученного из высокочистого нитрата марганца при 300°С анализировали при помощи оптического микроскопа «Сarl Zeiss Axio Imager М2.m» в отраженном свете (светофильтр «тёмное поле») и на электронном микроскопе «HITACHI S-3400N» с приставкой «Bruker X-Flash 4010» для рентгено-спектрального анализа.
Для определения механизма разложения кристаллогидрата нитрата марганца и установления причины образования кристаллических дефектов был проведен синхронный термический анализ, включающий дифференциальную сканирующую колориметрию (ДСК) и термогравиметрию (ТГ) кристаллогидратов 4- и 6-водного нитрата марганца (II) высокой чистоты на приборе синхронного термического анализа «Netzsch STA449c Jupiter», совмещенного с прибором «Bruker Tenzor27» для анализа отходящих газов по методу ИК-Фурье. Фазовый состав образцов определяли на рентгенофазовом дифрактометре «Shimadzu XRD-7000».
Результаты экспериментов и их обсуждение
На рисунках 1-2 представлены снимки покрытия диоксида марганца на пористом танталовом аноде промышленного образца конденсатора марки К53-68 (см. рис.1) и на поверхности покрытия MnO2, полученного после однократного цикла стадии пропитки заготовки анода нитратом марганца высокой чистоты с концентрацией 27% и последующего нагрева до температуры 300оС в атмосфере воздуха (рис.2). Видно, что на покрытии существуют кристаллические образования, нарушающие целостность покрытия.
|
|
|
С помощью элементного анализа установлено, что в исследуемом образце (анализ проведен в зоне нахождения белых кристаллов - см. рис. 2) содержатся оксид марганца и оксид тантала, относящийся к составу подложки (см. табл.1).
Таблица №1
Элементный анализ кристаллов на поверхности покрытия MnO2на танталовом аноде.
Элемент |
Атомный номер |
Массовые проценты, % масс. |
Количество атомов, % ат. |
Доля ошибки, % |
|
Mn |
25 |
32,8 |
19,79 |
0,8 |
|
Ta |
73 |
31,25 |
5,73 |
0,8 |
|
O |
8 |
35,94 |
74,48 |
3,7 |
Причинами образования и роста скоплений кристаллов на покрытии MnO2, получаемых в процессе нагревания нитрата марганца могут являться:
- Неполное разложение нитрата марганца;
- Сорбция кислорода и паров воды из воздуха на промежуточных стадиях производства с образованием нового соединения;
- Перестройка кристаллической структуры MnO2.
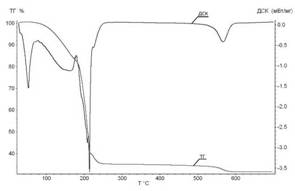
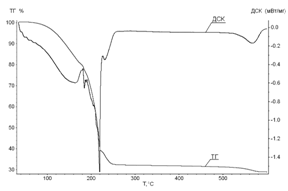
Проведение синхронного термического анализа позволило определить температурные интервалы протекания промежуточных процессов в кристаллогидратах нитрата марганца. Термограммы нагрева четырех- и шестиводного нитрата марганца до 600ºС в токе воздуха приведены на рисунке 3.
А Б
Рис.3. Термограмма ТГ/ДСК нагрева: А - Mn(NO3)2∙4H2O и Б - Mn(NO3)2∙6H2O в атмосфере воздуха, скорость нагрева 10 град/мин
Из результатов съемки термограммы установлено, что процессы, сопутствующие нагреванию кристаллогидратов 4-х и 6-ти водного нитрата марганца, имеют схожий характер. Для Mn(NO3)2∙4H2O характерен пик плавления при температуре 32°С, так как при комнатной температуре данный кристаллогидрат находится в твердом состоянии, в отличии от шестиводного нитрата марганца. Отличия между кристаллогидратами заключаются в температурах протекания дегидратации с параллельными реакциями гидролиза и окислительно-восстановительной реакции (ОВР). Незначительное отличие температурных интервалов для пиков ДСК (энтальпии протекающего процесса) на термограммах можно объяснить тем, что 4-водный нитрат марганца получают путем упаривания 6-водного, а значит, он частично проходит стадию гидролиза. Результаты анализа температурных интервалов протекающих процессов при нагревании Mn(NO3)2∙4H2O и Mn(NO3)2∙6H2O на термограммах представлены в табл. 2.
Таблица №2
Показатели термического анализа Mn(NO3)2∙4H2O / Mn(NO3)2∙6H2O
№ |
Т0, °С |
Тmax, °С |
Тк, °С |
∆m, % |
Процесс |
|
1 |
32,0 / 18,5 |
52,8 / - |
77,0 / 25,3 |
0 / 0 |
Плавление |
|
2 |
77,0 / 25,3 |
161,7 / 164,0 |
178,0 / 181,0 |
17,22 / 19,57 |
Дегидратация + гидролиз |
|
3 |
178,0 / 181,0 |
208,6 / 184,8 |
211,0 / 188,0 |
32,31 / 3,70 |
Дегидратация + гидролиз |
|
4 |
211,0 / 188,0 |
214,1 / 189,0 |
223,4 / 190,1 |
10,97 / 2,70 |
Дегидратация + ОВР |
|
5 |
223,4 / 190,1 |
224,7 / 219,6 |
260,0 / 226,0 |
4,85 / 35,20 |
Дегидратация + ОВР |
|
6 |
260,0 / 226,0 |
- / 231,3 |
494,0 / 263,0 |
1,28 / 6,73 |
Дегидратация + ОВР |
|
7 |
494,0 / 263,0 |
567,0 / - |
606,0 / 513,0 |
2,43 / 1,61 |
Разложение MnO2 |
|
8 |
- / 513,0 |
- / 567,2 |
- / 599,8 |
- / 2,14 |
Разложение MnO2 |
Где Т0 – начальная температура протекания процесса;
Тmax – значение температуры в точке экстремума кривой ДСК;
Тк – конечное значение температуры протекания процесса;
∆m – изменение массы образца.
Результаты анализа термограмм показывают ступенчатый механизм удаления воды и диоксида азота. Однако, ранее образование MnO2 рассматривали с точки зрения диссоциации кристаллогидратов Mn(NO3)2∙хH2O, без учета протекающей реакции гидролиза [6]:
- 1) Mn(NO3)2. nH2O → Mn(NO3)2+nH2O (~100-180°С)(1)
- 2) Mn(NO3)2 → MnONO3 + NO2 (180-230°С)(2)
- 3) MnONO3 → MnO2 + NO2 (230-250°С) (3)
- 4) Общее уравнение разложения:
- Mn(NO3)2 . nH2O → МnO2 +2NO2+nH2O(4)
Благодаря проведению параллельного анализа состава отходящих газов при нагревании Mn(NO3)2∙6H2O по методу ИК-Фурье спектрометрии, удалось подтвердить совместное удаление воды и NO2. Доказано присутствие паров воды в продукте даже при высоких температурах (более 200°С). На основании диаграмм синхронного термического анализа и ИК-Фурье спектрограммы установлено, что вода в кристаллогидрате нитрата марганца неравноценна и удаление кристаллизационной воды нитрата марганца при температурах до 181°С не обеспечивает удаление химически связанной воды.
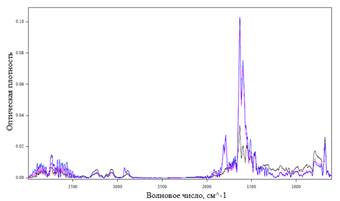
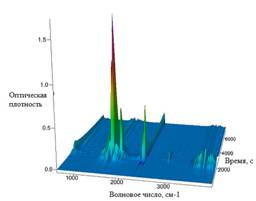
А Б
Рис. 4. ИК-Фурье спектрограмма отходящих газов при термолизе Mn(NO3)2x6H2O со скоростью нагрева 5°С/мин:
А) при Т=129, 153, 190°С; Б) при Т=30-650°С
Анализ ИК-Фурье спектрограммы отходящих газов показал, что процесс дегидратации начинается при температуре 30°С, которому соответствуют линии поглощения воды на диаграмме (3400-3800см-1). А начиная с температуры 129°С дегидратация протекает совместно с выделением NO2 (спектры поглощения 1459,3-1811,86см-1, 1629см-1, 1595см-1, 2886,25-2921,59 см-1). Также при 129°С появляются спектры с длинной волны (794см-1, 716см-1, 674см-1, 645см-1) соответствующие парам HNO3. Экстремум газовыделения наблюдается при температуре 153°С. Выделение H2O и NO2 заканчивается при температуре 215°С со скоростью нагрева 5°С/мин и 260-263°С при скорости нагрева 10°С/мин. Наличие воды при повышенных температурах показывает ее участие и большое влияние на протекающие химические реакции.
На основании полученных данных предложен механизм термолиза нитрата марганца, используемого в технологии получения покрытий MnO2 из нитрата марганца на пористых носителях и установлена вероятная причина формирования кристаллических дефектов на поверхности получаемого покрытия MnO2 после термолиза. Процесс термолиза Mn(NO3)2 заключается в поэтапном протекании реакций: вначале гидролиза нитрата марганца, а затем ступенчатого окисления иона Mn2+ по окислительно-восстановительным реакциям (ОВР) с параллельной дегидратацией прекурсора. Химизм процесса термолиза:
1) Гидролиз растворов Mn(NO3)2 на стадии пропитки носителя с подогревом:
Mn(NO3)2 + HOH ↔ Mn(OH)NO3 + HNO3 ∆G60°С =-16,895кДж (5)
2) Окислительно-восстановительная реакция в печи при нагревании:
Mn(OH)NO3 → MnOOH + NO2↑ ∆G300°С=-58,177кДж (6)
3) Последующая ОВР при нагревании в печи:
4MnOOH + O2 300°C→ 4MnO2 + 2H2O↑ ∆G300°С =-90,189кДж (7)
Побочные процессы в технологии получения диоксида возможны при не полном разложении оксогидроксида марганца или недостатке кислорода:
4MnOOH + O2 + (4n-2)H2O → 4(MnO2∙nH2O) (8)
2MnOOH → Mn2O3+H2O ∆G300°С =-1,27кДж (9)
Гидролиз гидроксонитрата марганца по 2 ступени термодинамически невозможен при данных условиях:
Mn(OH)NO3 +HOH ↔ Mn(OH)2 + HNO3 ∆G300°С =+30,672кДж (10)
На стадии дегидратации при нагревании кристаллогидрата Mn(NO3)2 (4 или 6-водного), на фоне протекающего ускоренного процесса гидролиза нитрата марганца происходит сопутствующее образование гидроксонитрата, переходящего далее в оксогидроксид марганца по окислительно-восстановительной реакции. Таким образом, ионы Mn2+ в ходе ОВР поэтапно окисляются сначала в Mn3+, а затем в Mn4+.
Образование гидроксонитрата марганца подтвердили рентгенофазовым анализом покрытия, полученного в виде сросшихся микротрубок. Они возникли после пропитки пористого носителя нитратом марганца различных концентраций (10, 27, 42, 57, 62%) при длительном хранении в темноте (3-5недель) при комнатной температуре.


А Б
Рис. 5. Внешний вид микротрубок Mn(OH)NO3 на поверхности анода конденсатора, А – увеличение 500Х, Б – увеличение 1000Х.
Диаметр микротрубок составляет 1-10мкм. Они прорастают из основания пористого танталового носителя и покрывают поверхность под небольшим углом. В составе трубок содержится моногидрат гидроксонитрата марганца и диоксид марганца в структурном типе рамсделлит, близкого по структуре к γ-MnO2 (наиболее электропроводящей и наиболее каталитически активной структуры MnO2).
На основании термодинамического анализа окислительно-восстановительной реакции окисления MnOOH (см. реакцию 7) установлено, что MnOOH сохраняет свое присутствие даже при повышенных температурах (по научным данным [9-10] составляет 120-325°С). Так при 250°С в прекурсоре остается 15%масс. оксогидроксида марганца, а при 300°С – 10%масс. При этом известно [10], что оксогидроксид марганца способен к протеканию медленной реакции перекристаллизации с формированием гидратированной структуры диоксида марганца MnO2∙nH2O при хранении в комнатных условиях по реакции 8. А значит причиной образования кристаллических дефектов на поверхности покрытия MnO2 после термолиза, является остаточное количество MnOOH. Такие дефекты, нарушают целостность катодного (MnO2) и диэлектрического (Ta2O5) покрытий на пористых танталовых анодах конденсаторов и снижают качество продукции.
Протекание процесса термолиза нитрата марганца сопровождается образованием промежуточных соединений: гидроксонитрата марганца, оксогидроксида марганца и его дальнейшего окисления с образованием диоксида марганца. Следы полупродукта MnOOH способны к поглощению кислорода и паров воды из атмосферного воздуха с протеканием вторичных процессов на катодном покрытии после извлечения из печи. Указанный момент отрицательно сказывается на химическом составе и целостности покрытия MnO2 на поверхности пористого танталового анода конденсатора, что негативно влияет на его качество. Образование кристаллических дефектов из остатков оксогидроксида марганца может приводить к ухудшению электрических характеристик танталового конденсатора из-за неоднородности катодного покрытия MnO2.
Таким образом, результаты исследование процесса термолиза нитрата марганца позволяют определить условия создания покрытий MnO2 необходимого качества без кристаллических дефектов на его поверхности и способствуют совершенствованию технологии получения диоксида марганца методом термолиза в различных сферах его применения.
Литература:
-
- Ренне В.Т. Электрические конденсаторы. Л.: Энергия, 1969, 502с.
- Ныркова Л.И. Синтез и физико-химические свойства диоксида марганца [Текст]. Автореферат дис-ии на получение степени канд. хим. н. Киев: Изд-во Инст-та общ. и неорг. химии им. В.И. Вернадского, 1996. – 18с.
- Старостин А.Г., Лановецкий, С.В. Пойлов В.З. Влияние характеристик поверхностных явлений нитрата марганца на пропитку танталового анода конденсатора [Электронный ресурс] // «Инженерный вестник Дона», 2013, №2. – Режим доступа: http://www.ivdon.ru/magazine/archive/n2y2013/1728 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Фиговский О. Нанотехнологии: сегодня и завтра. (Зарубежный опыт, обзор) [Электронный ресурс] // «Инженерный вестник Дона», 2011, №3. – Режим доступа: http://ivdon.ru/magazine/archive/n3y2011/511 (доступ свободный) – Загл. с экрана. – Яз. рус.
- Jae Kun Kim, Jee Young Yoo. A Study on the Characteristics of Tantalum Condenser over the Pyrolysis Temperature of Manganese nitrate by using a Dry-Radiational Furnace. Hwahak konghak Vol. 41, No. 3, June, 2003, pp. 337-342.
- Jaekun Kim, Hyungjin Yu, Woonghee Hong. A Study on the Characteristics of Solid Capacitor According to the Pyrolysis Methods. Korean Chem. Eng. Res., Vol. 44, No. 6, December, 2006, pp. 614-622.
- Вержбицкий Ф.Р. Высокочастотно-термический анализ. – Иркутск: Изд-во Иркутского ун-та, 1986. – 240с.
- Maria Folvari. Handbook of thermogravimetric system of minerals and its use in geological practice. Budapest: Occasional Papers of the Geological Institute of Hungary. Vol. 213. 2011, pp. 28-46.
- Ященко А.И. Термический метод определения состава оксида марганца. // Сборник статей магистрантов. Выпуск №8 / Тамбов. Издательство ТГТУ. 2006. – с.102-104.
- Лидин Р.А. Химические свойства неорганических веществ: Учеб. пособие для вузов. – 3-е изд., испр. – М.: Химия, 2000. – с.399.

