Электрохимическое окисление титана в электролитах на основе глицерина с высоким содержанием воды
Аннотация
Дата поступления статьи: 30.03.2013Исследованы закономерности электрохимического синтеза диоксида титана в разбавленных растворах глицерина в присутствии фторида аммония при потенциалах 2-14 В. Проведено математическое планирование процесса синтеза по планам первого порядка с использованием полного трехфакторного эксперимента, получены адекватные уравнения регрессии для процессов формирования диоксида титана в области потенциалов 8-14 В. Методом электронной микроскопии доказана пористость синтезируемых слоев диоксида титана. Установлено влияние содержания воды в электролите на скорость электрохимического процесса и влияние величины потенциала на выход диоксида титана по веществу. Показано, что при выбранных условиях электролиза электрохимический процесс сопровождается значительным химическим растворением титана. Электрохимические процессы в водосодержащем глицерине исследованы методом циклической вольтамперометрии.
Ключевые слова: титан, диоксид титана, электрохимическое окисление, глицерин, фторид аммония, планирование эксперимента
05.17.03 - Технология электрохимических процессов и защита от коррозии
Введение
Оксиды металлов широко востребованы в различных областях приборостроения [1, 2]. Пористый диоксид титана, синтезированный электрохимическим методом, наряду с другими оксидами является одним из перспективных материалов для использования в солнечных элементах и катализаторах очистки водной и воздушной сред.
Основными особенностями электрохимического синтеза диоксида титана является использование высоких потенциалов окисления и фторидсодержащих электролитов [3-7]. Процессы, протекающие при синтезе диоксида титана, мало изучены. По нашему мнению, исследования синтеза диоксида титана в электролитах на основе различных растворителей при значениях потенциалов, близких к потенциалу окисления титана, актуальны.
Ранее мы исследовали синтез тонких слоев пористого TiO2 при низких значениях потенциалов в водосодержащих органических электролитах на основе этиленгликоля, глицерина, изопропанола [8].
В настоящей публикации представлены результаты исследования процесса синтеза диоксида титана в глицерине с высоким содержанием воды при потенциалах 2-14 В в присутствии фторида аммония.
Методика эксперимента
Электрохимические синтезы проводили в потенциостатическом режиме в трехэлектродной стеклянной ячейке на потенциостате P-30I при температуре окружающей среды (17-19° С). Состав электролита: глицерин с добавлением воды (45-55%), электролитная добавка – фторид аммония (0,25-0,75%). Анодом являлся напыленный на ситалл Ti (99,99%) толщиной ~20 мкм и площадью 0,5 см2 (масса Ti 0,45 мкг), катод – титановая фольга площадью 2 см2, электрод сравнения – хлорсеребряный. Непосредственно перед началом синтеза проводили анодно-катодную поляризацию поверхности анода. Процессы исследовали методом циклической вольтамперометрии на точечном титановом электроде с рабочей поверхностью 0,01 см2. Микрофотографии получали на сканирующем электронно-зондовом микроскопе Quanta 200.
Результаты и их обсуждение
Для оценки влияния условий электролиза на процесс синтеза диоксида титана в электролите (глицерин + H2O + NH4F) с целью математического описания этого процесса использовали расширенные матрицы планирования полного 3-хфакторного эксперимента.
Постоянными условиями эксперимента были: объем электролита – 30 мл; температура 17 ÷ 19º С; анод – Ti площадью 0,5 см2; катод – Ti площадью 2 см2. Факторами варьирования были выбраны: Х1 – концентрация NH4F, %; Х2 – концентрация H2O, %; Х3 – значение потенциала, В. Функции отклика: Y – количество пропущенного электричества, Кл; Z – средняя плотность тока, мА/см2.
Исследовали процессы синтезов в двух областях потенциалов: от 2 до 8 В и от 8 до 14 В, соответственно, были составлены два плана экспериментов, которые приведены в таблице №1.
Условия проведения экспериментов в соответствии с матрицей полного 3-хфакторного эксперимента и средние значения функций отклика – в таблице №2 (опыты 1-8 относятся к области потенциалов 2-8 В, опыты 5-12 – к области потенциалов 8-14 В).
Таблица №1
Планы экспериментов
Характеристики плана |
Х1, % |
Х2, % |
Х3, В |
|
область потенциалов 2-8 В |
|||
|
1 |
2 |
3 |
4 |
Продолжение таблицы №1
1 |
2 |
3 |
4 |
|
Нулевой уровень |
0,5 |
50 |
5 |
|
область потенциалов 8-14 В |
|||
|
Нулевой уровень |
0,5 |
50 |
11 |
Таблица №2
Условия проведения экспериментов и значения функций отклика
№ оп |
Х1, % |
Х2, % |
Х3, В |
Yср эксп., Кл |
Yрасч., Кл |
Yрасч.*, Кл |
Zср эксп., мА |
Zрасч., мА |
Zрасч*., мА |
|
1 |
0,25 |
45 |
2 |
0,198 |
0,014 |
|
0,36 |
0,34 |
|
|
5 |
0,25 |
45 |
8 |
0,076 |
0,088 |
0,075 |
0,38 |
0,39 |
0,40 |
|
9 |
0,25 |
45 |
14 |
0,080 |
|
0,159 |
0,02 |
|
0,07 |
Примечание: Yср.эксп., Zср эксп – средние экспериментальные значения; Yрасч., Zрасч. и Y*расч., Z*расч – расчетные значения, соответственно, для областей потенциалов 2-8 В и 8-14 В.
После обработки результатов экспериментов получены адекватные уравнения регрессии для описания процессов в области потенциалов 8-14 В:
Y* = 0,25 + 0,13Х2 + 0,17Х3 + 0,12Х2Х3 ;
Z* = 0,27 + 0,11Х2 + 0,09Х1Х3 + 0,14Х2Х3 .
Доверительные интервалы соответствовали уровню значимости 0,05, значимость коэффициентов уравнений регрессии оценивали по критерию Стьюдента, адекватность уравнений проверяли с помощью критерия Фишера (F). Для функции Y* значение F = 2,07 < F0,95 (5; 8) = 3,7; для функции Z* значение F = 3,66 < F0,95 (5; 8) = 3,7, то есть представленные уравнения регрессии адекватно описывают процесс.
Процессы электрохимического модифицирования титана в исследованных электролитах в области потенциалов 2-8 В протекают нестабильно и не всегда сопровождаются формированием диоксида титана. Полученные уравнения регрессии неадекватны.
Известно, что в электролитах, содержащих ионы фтора, происходит сильное растворение титана [9]. Нами также установлено, что теоретически рассчитанное количество электричества на процесс синтеза TiO2 намного превышает реально затраченное. В соответствии с общепринятым механизмом синтез TiO2 происходит по реакциям:
Ti + O2– = TiO; 2TiO + O2– = Ti2O3; Ti2O3 + O2– = 2TiO2. Для окисления 0,45 мкг титана необходимо 0,3 мкг кислорода, на анодный синтез которого по закону Фарадея должно быть затрачено 3,6 Кл. Однако количество пропущенного электричества во всех рассмотренных случаях не превышает 25% от теоретически рассчитанного (таблица №2). То есть, химическое растворение титана происходит наряду с электрохимическим синтезом диоксида титана.
В соответствии с полученным уравнением регрессии для функции Y* увеличение потенциала проведения процесса электролиза и содержания воды в электролите способствует увеличению количества пропущенного электричества, то есть выход диоксида титана по веществу увеличивается.
Функция Z соответствует средней плотности тока и отражает скорость электрохимического процесса. Заметное влияние на скорость процесса (Z*) оказывает содержание воды. Чем больше разбавление глицерина, тем меньше его вязкость и, соответственно, выше подвижность электропроводящих ионов. Однако, по нашим данным, введение более 60 масс. % воды в электролиты на основе глицерина нецелесообразно, так как наблюдается ускорение процессов растворения титана и оксида титана вследствие повышения активности ионов в растворе.
Методом циклической вольтамперометрии исследованы процессы на титановом аноде в интервале потенциалов –2…3 В. В области потенциалов
–1,5…–1,4 В (Ag/AgCl, KCl(нас.)) на кривых наблюдается перегиб, который, вероятно, соответствует окислению титана: Ti → Ti2+ + 2e (Eº= –1,63 В) [10]. При потенциалах –0,2…–0,3 В (Ag/AgCl, KCl(нас.)) наблюдаются пики, которые мы объясняем электрохимическими реакциями образования пленок оксида титана по реакциям:
Ti2+ + 2H2O → TiO2 + 4H+ + 2e (Eº= –0,502 В),
2Ti2+ + 3H2O → Ti2O3 + 6H+ + 2e (Eº= –0,478 В) [10].
При скорости развертки потенциалов v = 1000 мВ/см величина пика невелика по сравнению с величиной пика, полученной при более медленной скорости развертки потенциалов v = 100 мВ/cм. В первом случае оксидный слой не успевает сформироваться (рис. 2, а), и поверхность титана остается открытой для реакций окисления катионов аммония и воды в области потенциалов +0…+2 В. Во втором случае (рис. 2, б) на поверхности титана формируется оксидный слой, который пассивирует поверхность, и реакция образования кислорода на аноде (~1,5 В отн. Ag/AgCl, KCl(нас.)) становится невозможной. На основании полученных данных формирование пористого TiO2 теоретически возможно при потенциалах выше 1,5 В при условии одновременного протекания реакций окисления катионов аммония до N2 (NO) и образования кислорода из воды, о чем ранее сообщалось в публикации [8].
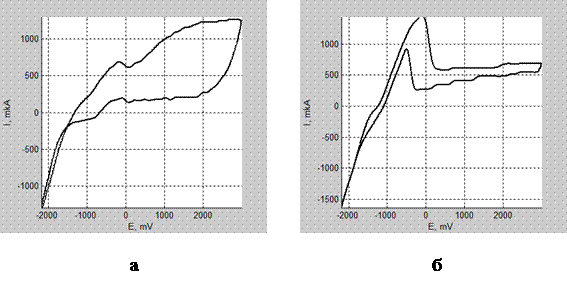
Рис. 1. – Циклические вольтамперные кривые в электролите (глицерин + 55% H2O + 0,75% NH4F): а – v = 1000 мВ/см; б – v = 100 мВ/см
По данным микроструктурного анализа (рис. 2) на аноде происходит формирование пористых слоев диоксида титана. Упорядоченность структуры расположения пор достаточно низкая, размеры пор варьируются в пределах 0,1-1 мкм в зависимости от состава электролита.

Рис. 2. – Микроструктура поверхности TiO2 (×20000)
Выводы:
Таким образом, в результате проведенных исследований установлено, что при электрохимическом окислении Ti в водосодержащем глицерине (1:1) образуется пористый TiO2 с выходом по веществу не более 25%. Максимальный выход по веществу достигается при потенциале 14 В и содержании воды 55%. Концентрация фторида аммония в исследованных условиях синтеза не является значимым фактором.
Литература:
- Мясоедова Т.Н., Сергиенко Д.В., Петров В.В., Коробкова А.И. Разработка технологии получения высокочувствительных сенсоров газов на основе оксида циркония для гибридных сенсорных систем // Инженерный вестник Дона. – №4/2. – 2012.
- Мясоедова Т.Н., Сергиенко Д.В., Петров В.В., Кошелева Н.Н. Разработка газочувствительного элемента на основе пленок оксидов меди для датчика аммиака // Инженерный вестник Дона. – №4/2. – 2012.
- Ruan C., Paulose M., Varghese O.K. et al. Fabrication of highly ordered TiO2 nanotube arrays using an organic electrolyte // J. Phys. Chem. B. – 2005. – Vol. 109. – Р. 15754-15759.
- Белов А.Н., Дронов А.А., Орлов И.Ю. Особенности электрохимического формирования слоев пористого оксида титана // Известия вузов. Электроника. – 2009. – №1(75). – С. 16-21.
- Taveira L.V., Macak J.M., Sirotna K. et al. Voltage oscillations and morphology during the galvanostatic formation of self-organized TiO2 nanotubes//: J. Electrochem. Soc. – 2006. – Vol. 153, –№ 4. – Р. B137-B143.
- Beranek R., Hildebrand H., Schmuki P. Self-organized porous titanium oxide prepared in H2SO4/HF еlectrolytes // Electrochem. and sol.-st. lett. – 2003. – Vol. 6, № 3. – Р. B12-B14.
- Н. Park, H.-G. Kim, W.-Y. Choi. Characterization of highly ordered TiO2 nanotube arrays obtained by anodic oxidation // Transactions on electrical and electronical materials. – 2010. – Vol. 11, № 3. – Р. 112-115.
- Марьева Е.А., Попова О.В. Влияние состава электролита на процесс электрохимического окисления титана // Известия ЮФУ. Техн. науки. – 2013.– №1. – С. 173-177.
- Якименко Л.М. Электродные материалы в прикладной электрохимии. М.: Химия, 1977. – 264 с.
- Никольский Б.П., Григоров О.Н., Позин М.Е. и др. Справочник химика. М.: Химия, 1965. – Т. 3. – 1008 с.